Una de las habilidades que se evalúan cuando se hace un examen de química es el balanceo de ecuaciones. Para eso es importante conocer estar familiarizado con los elementos de la tabla periodica para ello puedes visitar esta liga. Las ecuaciones químicas no son otra cosa que la interacción (mezcla o convinación) entre uno o mas elementos. Al final hay un video donde se explica el tema.
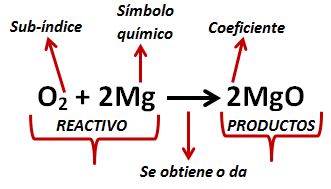
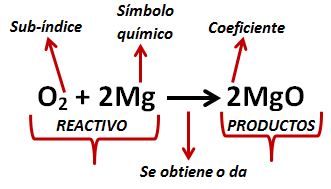
En la parte izquierda de la ecuación tenemos los “reactivos” que son los elementos que se unen para dar el producto, la flecha nos indica lo que se obtiene al combinar dichos elementos.
En la ecuación, las letras indican los símbolos químicos, estos se pueden representar con una letra mayúscula, o con una mayúscula y minúscula juntas.
El número pequeño en la parte inferior derecha de cada símbolo químico es el sub-índice y nos indica el número de átomos, de ese elemento, que intervienen en la ecuación.
El número grande es el coeficiente y nos indica la cantidad de moléculas que se forman con los elementos.
Balancear una ecuación quiere decir que debemos tener la misma cantidad de átomos en ambos lados de la fecha, en otras palabras, lo mismo que esta a la izquierda debe estar a la derecha, aunque sea en diferente orden.
Para contar los átomos se toma en cuenta el sub-índice y el coeficiente de cada elemento.
Ejemplos:
2H2 Aquí tenemos 2 átomos de hidrogeno, lo obtenemos multiplicando el coeficiente por el sub-índice.
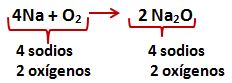
![]() Cuando el coeficiente esta al inicio cuenta para todos los símbolos químicos que están al frente de él. Contando tenemos 4 átomos de sodio (Na) y dos de oxigeno (O)
Cuando el coeficiente esta al inicio cuenta para todos los símbolos químicos que están al frente de él. Contando tenemos 4 átomos de sodio (Na) y dos de oxigeno (O)
Una vez que aprendes a identificar la cantidad de átomos, puedes balancear ecuaciones y en la Tabla Periódica vas a encontrar el nombre y la abreviación de cada elemento.
Ejemplo I
![]()
El sodio (Na) reacciona con el oxígeno (O) y produce oxido de sodio ![]()
PASO I Identifica la cantidad de átomos que intervienen en los reactantes (izquierda) que tenemos.
![]()
4 Sodios
2 Oxígenos
PASO II Identifica la cantidad de átomos que se producen
![]()
2 sodios
1 oxígenos
PASO III Determinar si la ecuación esta balanceada o no. Es este caso no porque nos faltan dos sodios y un oxígeno.
PASO IV Modificar la ecuación para que quede balanceada. Para tener 4 sodios (Na) incluimos un coeficiente, en este caso el 2.
![]()
PASO IV Por ultimo confirma que la ecuación este balanceada
Ejemplo II
![]()
En esta ecuación tenemos el metano ![]() que es un gas y reacciona en contacto con el oxígeno (O) y una chispa. De esta reacción se produce agua
que es un gas y reacciona en contacto con el oxígeno (O) y una chispa. De esta reacción se produce agua ![]() y dióxido de carbono
y dióxido de carbono ![]()
PASO I Identifica la cantidad de átomo que se tienen en los reactantes (parte izquierda de la flecha)
![]()
1 carbono
4 hidrógenos
2 oxígenos
PASO II Identifica la cantidad de átomos que se producen (parte derecha de la flecha).
![]()
1 carbono
2 hidrógenos
3 oxígenos
PASO III Determinar cuántos átomos de cada elementos nos hacen falta y analiza que coeficientes agregarías para balancear la ecuación.
![]()
Primero ¿qué coeficiente tendrías que agregar para que en la molécula del agua ![]() haya 4 hidrógenos? Una vez que agregues los hidrógenos balancea nuevamente la ecuación y determina que cantidad de átomos de oxigeno te hacen falta en el lado izquierdo de la flecha y escribe el coeficiente correspondiente.
haya 4 hidrógenos? Una vez que agregues los hidrógenos balancea nuevamente la ecuación y determina que cantidad de átomos de oxigeno te hacen falta en el lado izquierdo de la flecha y escribe el coeficiente correspondiente.

Observa como los 4 oxígenos están distribuidos 2 en la molécula del agua y 2 en el dióxido de carbono.
Al balancear una ecuación es posible que tengas que hacer cambio tanto en los reactantes y en los productos.
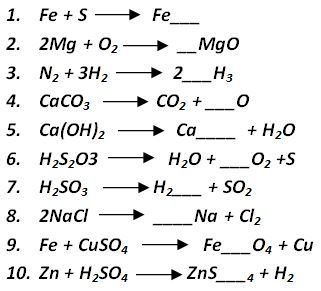
EJERCICIOS DE PRACTICA
Identifica la cantidad de átomos que se encuentran en los reactantes (parte izquierda de la ecuación) y determina que cambio debes hacer en los productos (parte derecha). Si no conoces el elemento que representa cada simbolo quimico, revisa la Tabla Periódica.
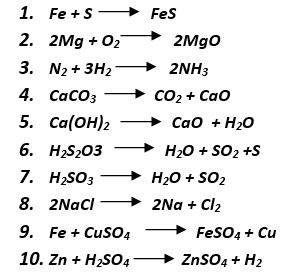
RESPUESTAS

Bien explicado. Gracias
Bien explicado. Gracias Lucesita. Aunque se me esta haciendo dificultoso..
Gracias Alex
Si creo que de ciencias los temas mas difíciles son los de química y física, pero poco a poco se va dominando el tema. Saludos!!
Muchas gracias está bien expicado dicipa dudas. La número ocho te quedó mala
Son dos coloro.
Si Alba, ya quite el 3 😉
Que interesante!!
Hola Luz, gracias por esta explicacion me ha ayudado mucho. Tengo la cita del examen le dejare saber com me va a ir. 🙂
Mucha suerte Gaspar!!
Para el examen de ciencias las preguntas mas confusas y dificiles tienen que ver con química y física, también ten presente que deben saber obtener la media (promedio), mediana, moda y rango de datos estadisticos, es la parte de matemáticas que se evalua en ciencias y sociales.
Muy bien, gracias por la
Muy bien, gracias por la informacion Luz. practicare mucho esas destrezas..
saludos
Hola Luz, le cuento que ya pase ciencia muchas gracias por tu ayuda ya solo me faltan sociales y lectura.
WOW MUCHAS FELICIDADES GASPAR!!
Me da mucho gusto recibir esta noticia, MUCHAS FELICIDADES y la mejor de las suertes en los examenes que te faltan. Saludos!!!
Gracias el sub dice de la número ocho es dos tuviste un herror.
Igual muchas gracias.
Gracias por la observación Alba. ¡Saludos!!
Graciasss!!
Sii asi es, quiero terminarlo pronto. 🙂
Que legibilidad para explicar
Gracias por todo.
Gracias por tu comentario Verónica, eres muy amable 🙂
buenas noches me podria decir como balancear esta ecuacion
6CO2 + 5H2O = C6H12O6 + 6O2
gracias
La ecuación no está balanceada. Debe ser:
6CO2 + 6H2O = C6H12O6 + 6O2
Buenos días, ha sido una muy buena explicación.
Me preguntaba si me podría mandar un tipo examen para entrar a la universidad en donde este ese tema y ejercicios, o una guía. Se lo agradecería
Hola Joahan, ¿te refieres a una universidad en Estados Unidos?