Para este tema, revisa el contenido teórico, el video y al final hay unas preguntas de practica. Entre los contenidos de matemáticas que se pueden incluir en el examen de CIENCIAS esta la notación cientifica, regla de tres (proporciones) y pueden también preguntarte temas relacionados con la media (promedio), mediana, moda y rango. Las imagenes y parte del contenido teórico son parte de los recursos didácticos que ofrece la UNAM, aquí puedes ver parte de los contenidos. En este otro enlace puedes encontrar otros recursos didácticos que ofrece la UNAM para estudiar temas de química de manera gratuita.
Los electrones son 1836 veces más pequeños que las otras partículas que los protones y neutrones. La masa total del átomo de cada elemento es la suma de protones y neutrones. Esa información se indica en la tabla periódica y se conoce como “medida en UMA”, Unidades de Masa Atómica.
Una UMA equivale a la masa de un protón o un neutrón y es tan pequeña que expresada en kilogramos sería del orden de1.7×10-27kg
Cuando varios elementos se combinan para formar una molécula, la masa de la nueva molécula será la suma de la masa de cada elemento presente en ella. Por ejemplo, la masa molecular de una molécula de agua es de 18 UMA, ya que cada hidrógeno contiene una UMA y el oxígeno 16 UMA. Esto equivale a3.6 x10-26kg.

Como puedes ver, estas son cantidades muy pequeñas y no existe una balanza que pueda medir dichas cantidades de materia, pero si es posible medir 18 gramos de agua por lo que los químicos utilizan el concepto de MOL “número de moléculas de agua” cuya masa es de 18 gramos.
Los átomos son infinitamente pequeños y la unidad utilizada para contarlos es muy grande y equivale a MOL = 6.2×1023 partículas.
Esta cantidad es conocida como número de avrogrado, un MOL de cualquier sustancia tiene ese número de partículas. Por ejemplo,
En 18 gramos de agua existen 6.2×1023 moléculas de agua.

Ahora, hay que tener presente que los átomos de diferente sustancia tienen diferente masa porque la cantidad de protones y neutrones es diferente. Por lo tanto, un MOL de diferente sustancia tendrá diferentes masas.
Veamos un ejemplo: Para el MOL de carbono con6.2×1023 tiene una masa de 12 gramos porque la masa atómica del carbono es 12 UMA. El MOL es una unidad de cantidad fija de partículas 6.2×1023 pero de masa variable.

Otro ejemplo aplicado a sustancias:
Un MOL de cloruro de sodio con 6.2×1023 tiene una masa de 58.4 g/mol porque la masa atómica del Sodio es de 22.9 UMA y la del cloro es de 35.5 UMA.

Un MOL de “dióxido de carbono” con 6.2×1023 tiene una masa de 44 g/mol porque el oxígeno tiene una nada de 16 UMA y el carbono 12 UMA.

Podemos concluir que un mol de cualquier elemento o sustancia tiene masa igual a su masa molecular expresada en gramos, a esta cantidad se le llama MASA MOLAR.
PREGUNTAS DE PRACTICA
- Los electrones son 1836 veces mas pequeños que las partículas. Una UMA (unidades de masa atómica) equivale a la masa de un protón y un neutrón y es tan pequeña que expresada en kilogramos sería del orden de 1.7×10-27 kg.La masa molecular del agua es de 18 UMA ya que el oxígeno tiene 16 UMA y el hidrógeno 2 cada uno. Estas son cantidades muy pequeñas y no existe una balanza que pueda medir dichas cantidades de materia, pero si es posible medir 18 gramos de agua por lo que los químicos utilizan el concepto de MOL “número de moléculas de agua” cuya masa es de 18 gramos. Sabiendo esa información ¿A cuánto equivaldría la masa molecular del agua expresada en kilogramos?
- De la siguiente lista de elementos que forman parte de los alcalinos y alcalinotérreos en la tabla periódica, ¿A cuánto equivale la UMA del Calcio?
Para las preguntas 3 y 4 usa la siguiente imagen.
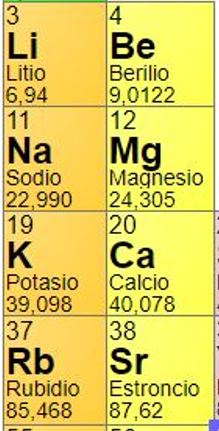
3. ¿Cuál es el rango de UMA en la lista de elemento?
4. Obtén la media (promedio) y mediana usando el valor de UMA de cada elemento.
5. Los átomos son infinitamente pequeños y la unidad utilizada para contarlos es muy grande y equivale a MOL= 6.2×1023 partículas. Esta cantidad es conocida como número de avogadro, un MOL de cualquier sustancia tiene ese número de partículas. Por ejemplo, En 18 gramos de agua existen 6.02×1023 moléculas de agua. Ahora, hay que tener presente que los átomos de diferente sustancia tienen diferente masa porque la cantidad de protones y neutrones es diferente. Por lo tanto, un MOL de diferente sustancia tendrá diferentes masas. Veamos un ejemplo: Para el MOL de carbono con 6.2×1023 tiene una masa de 12 gramos porque la masa atómica del carbono es 12 UMA. El MOL es una unidad de cantidad fija de partículas 6.2×1023 pero de masa variable. Otro ejemplo aplicado a sustancias:
Un MOL de cloruro de sodio (NaCl) con 6.2×1023 tiene una masa de 58.4 g/mol porque la masa atómica del Sodio es de 22.9 UMA y la del cloro es de 35.5 UMA. ¿A cuánto equivale un MOL de Oxido de Litio cuya formula molecular es Li2O? Usa la tabla periodica como referencia para obtener tu respuesta.
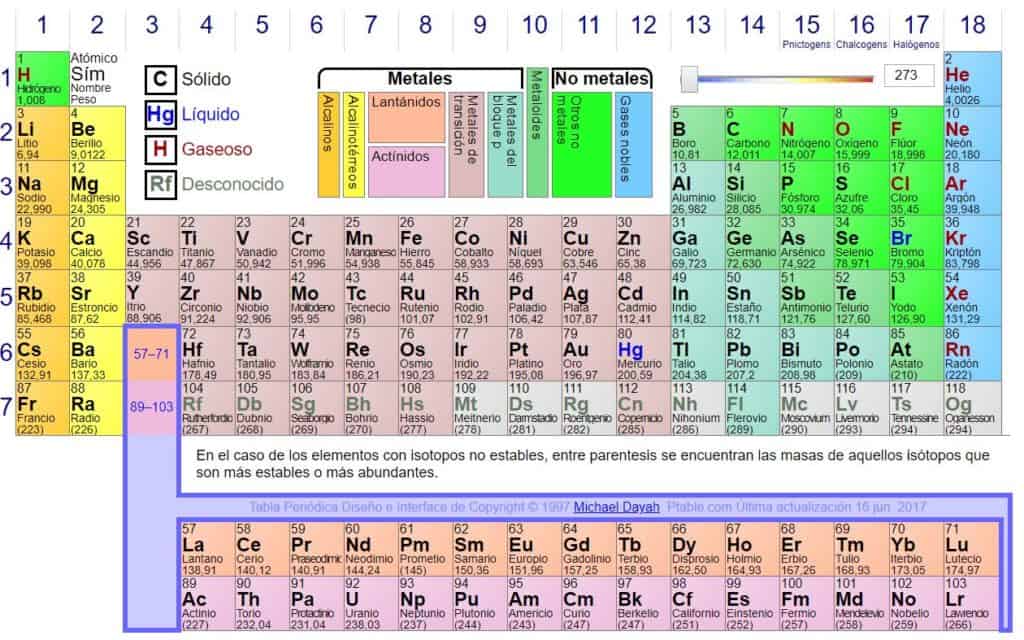
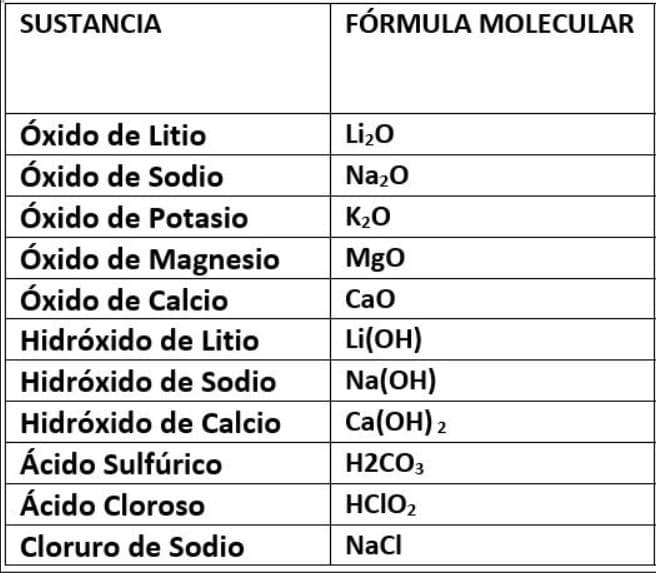
6. Ahora que ya sabes identificar la UMA y obtener el peso molecular de cada sustancias, practica con las siguientes sustancias.
RESPUESTAS
- 06X10-26 kg
- 40 UMA
- 80.68
- media (promedio) = 39.4389, mediana = 31.7015, no hay moda
- Redondeada la respuesta a la unidad, nos da:
- Óxido de Litio 30
- Óxido de Sodio 62
- Óxido de Potasio 94
- Óxido de Magnesio 40
- Óxido de Calcio 56
- Hidróxido de Litio 24
- Hidróxido de Sodio 40
- Hidróxido de Calcio 74
- Ácido Sulfúrico (H2CO3) 110
- Ácido Cloroso 68
- Cloruro de Sodio 58
