La estequiometría es la parte de la química que nos permite determinar la masa de combinación de las sustancias en una reacción química. En una reacción química la máxima cantidad de producto que se puede formar depende de los reactivos. Estos son las sustancias o moléculas que forman un producto. Dentro de una reacción química se pueden presentar los “reactivos limitantes” que son aquellos que se consumen primero y limitan la cantidad de producto que se puede formar.
También podemos tener los reactivos en exceso que son los que se encuentran presentes en mayor cantidad
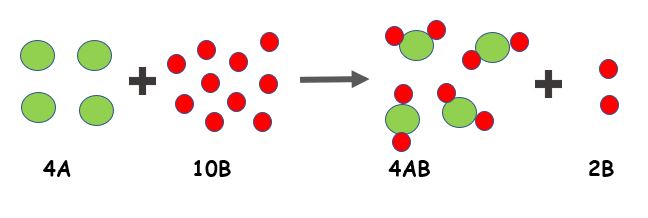
En este modelo tenemos que el 4A es el reactivo limitante que ya al ser 4 solo se pueden formar ese número con AB. Por el contrario, el reactivo en exceso esta representa por 2B.
Lo mismo pasa si lo representamos en una ecuación química. Por ejemplo, si tenemos 5 moles de Sodio peros solo un mol de cloro diatónico. Se pueden formar solo dos moles de cloruro de sodio y sobrarían 7 moles de sodio.
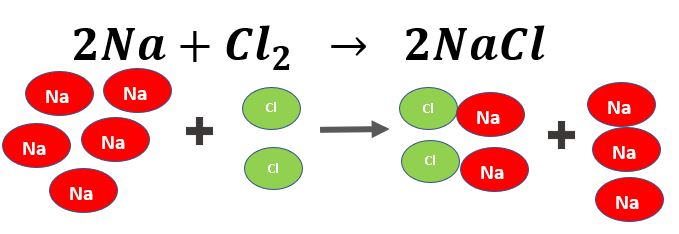
Ahora veamos otros ejemplos:
Para una reacción, 124g de aluminio (Al) reaccionan con 601 g de óxido férrico (Fe2O3). La ecuación que representa dicha reacción química es la siguiente:
Si queremos identificar el reactivo limitante, hay que seguir los siguientes pasos.
PASO I
Obtener y acomoda los valores de la masa en gramos (m), el peso molecular (M) y los MOLES (n) de los reactivos.

- m (masa en gramos)
- M (peso molecular)
- n (MOLES)
PASO II
Para identificar el reactivo limitante hay que dividir los coeficientes de cada sustancia presente en los reactivos de la ecuación. Después divide el valor de “n” MOLES del Al entre los de Fe2O3

El reactivo limitante es el aluminio y el reactivo en exceso es el óxido férrico (Fe2O3).
Una vez que tenemos esos valores podemos también calcular la masa en gramos de los productos Al20 y 2Fe
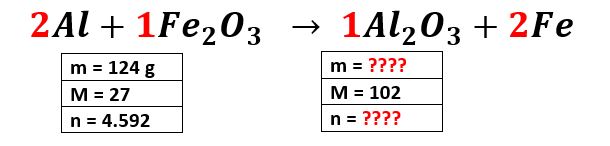
Como desconocemos el valor de “n” hay que aplicar la regla de tres para obtenerlo.
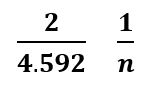
Aplicando la regla de tres hacemos la siguiente operación: 4.592 x 1 ÷ 2 = 2.296
El valor de n= es 2.296, con este valor podemos obtener la masa en gramos multiplicando 2.296 x 102 y nos da 234.192 g. Quiere decir que la masa de Al2O3 es igual a 234.192g. Puedes seguir los mismos pasos para calcular la masa en gramos de 2Fe.
Ejemplo II
Determina los reactivos limitantes y en exceso si hay 75 gramos de sodio y 115 gramos de oxígeno.
- m (masa en gramos)
- M (peso molecular)
- n (MOLES)
PASO I Acomoda los valores de la masa en gramos (m), el peso molecular (M) y los MOLES (n) de los reactivos.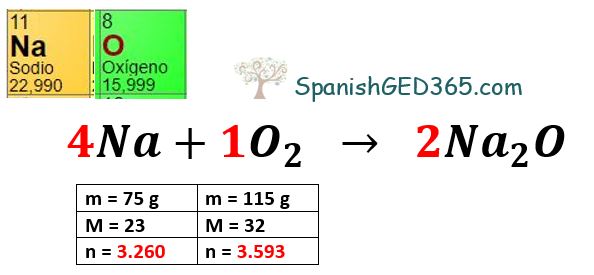
PASO II
Dividir el número mas grande entre el mas chico basado en los coeficientes presentes en la formula química (4 ÷ 1 = 4)
Divide el valor de “n” MOLES del Na entre los de O
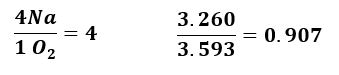
Si el valor disminuye, el reactivo limitante es el Na, porque fue el número que dividimos.
Si el valor de los MOLES fuera mayor, el Na sería un reactivo en exceso.
PASOS PARA CALCULAR LA MASA DEL PRODUCTO
PASO I
Acomodamos los valores que tenemos del Oxido de Sodio
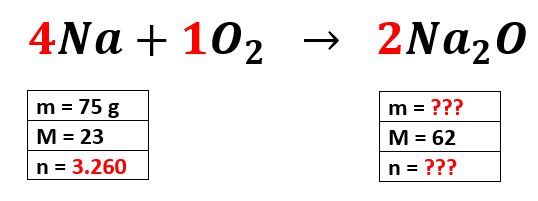
Como desconocemos el valor de “n” hay que aplicar la regla de tres para obtenerlo.
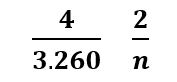
Aplicando la regla de tres hacemos la siguiente operación: 3.260 x 2 ÷ 4 = 1.63
El valor de n= es 1.63, con este valor podemos obtener la masa en gramos multiplicando 1.63 x 62 y nos da 101.06 g
