Los enlaces químicos son uniones que se dan entre átomos y moléculas al que ceden, toman o compartir electrones. Al darse este proceso, se alterar las propiedades físicas y químicas de los átomos.
Los enlaces formar compuestos químicos mas grandes y complejos que también pueden romperse bajo ciertas y determinadas condiciones como el cambio de temperatura o acciones de la electricidad.
Hay tres tipos de enlaces, los IÓNICOS, COVALENTES y METALICOS. Átomo de oxígeno Ión de oxígeno
ENLACE IÓNICO
Los enlaces iónicos se dan cuando un átomo metálico pierde y un átomo no metálico gana electrones.
Se llama IÓN al átomo que al perder o ganar un electrón de su numero acostumbrado, queda cargado eléctricamente.
Se llama CATIÓN al átomo que pierde un electrón y se carga positivamente.
Se llama ANIÓN al átomo que gana un electrón y se carga negativamente.
Este tipo de enlace se combina entre átomos que tiene (1,2 o 3 electrones) en su último nivel de energía con átomos de 5, 6 y 6 electrones.
Ejemplo: Cloruro de sodio
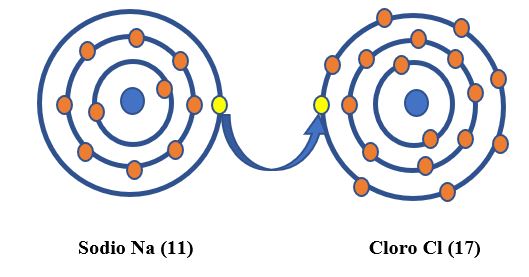
En el Cloruro de Sodio, el Sodio pierde un electrón y queda cargado positivamente; el Cloro gana un electrón y queda cargado negativamente.
Otros ejemplos de compuestos con enlaces IÓNICOS
- Óxido de magnesio (MgO)
- Sulfato de cobre (CuSO4)
- Ioduro de potasio (KI)
- Cloruro de manganeso (MnCl2)
- Carbonato de calcio (CaCO3)
- Sulfato de Hierro (Fe2S3)
ENLACES COVALENTES
Estos se dan cuando dos o mas átomos comparten electrones hasta completar su capa externa.
Hay tres tipos de enlaces covalentes
1. ENLACE COVALENTE PURO
Un ejemplo lo tenemos con el puente de Hidrógeno, el cual tiene solo un electrón y necesita de otro electrón para completar el par en el primer nivel de energía.

2. ENLACE COVALENTE POLAR
Se forma al compartir electrones de cada uno de los átomos.
Monóxido de azufre: ambos tienen 6 electrones en su último nivel de energía y comparten dos cada uno para completar ocho electrones en su último nivel de energía.
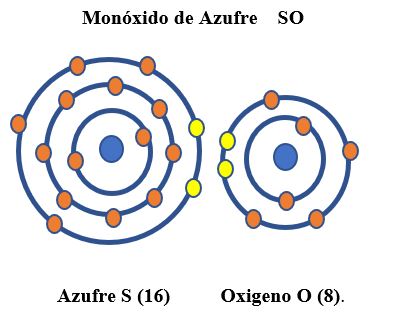
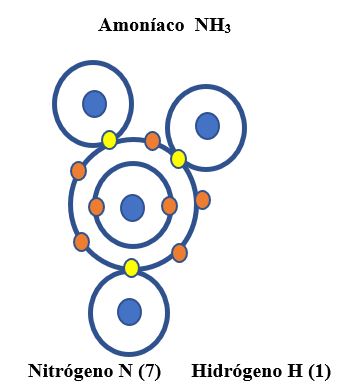
3. ENLACE COVALENTE COORDINADO O TRIPLE
Se forma al compartir tres pares de electrones. En el caso del amoníaco, el Nitrógeno tiene cinco electrones en su último nivel de energía y tres Hidrógenos se unen para completar los ocho electrones.
Ejemplos de enlaces covalentes:
- Benceno (C6H6)
- Metano (CH4)
- Glucosa (C6H12O6)
- Amoníaco (NH3)
- Freón (CFC)
- Todas las formas del carbono (C)
ENLACE METALICO
Se da cuando se unen dos o mas metales. Un ejemplo lo tenemos en el bronce que se forma con a aleación de cobre, estaño y zinc.
Ejemplos de elementos con enlaces metálicos:
- Barras de hierro (Fe)
- Yacimientos de cobre (CU)
- Barras de oro puto (Au)
- Barras de plata pura (Ag)

Es mui interesante